初めての経口 COVID-19 抗ウイルス薬―モルヌピラビル(商品名ラゲブリオ)
2021年12月24日に製造販売を特例承認した米・メルク開発の新型コロナウイルス感染症(COVID-19)の経口薬モルヌピラビル(商品名ラゲブリオ)について、12月27日から本邦でも処方できるようになりました。
かなり大きなカプセルです。1回4カプセル、1日2回、5日間の服用です。
作用機序はRNAポリメラーゼ阻害薬で、感染細胞内に侵入した新型コロナウイルスにおけるRNA依存性 RNAポリメラーゼに作用することにより、ウイルスRNAの配列に変異を導入しウイルスの増殖を阻害する作用です。レムデシビルやアビガンと同様な作用機序です1)。
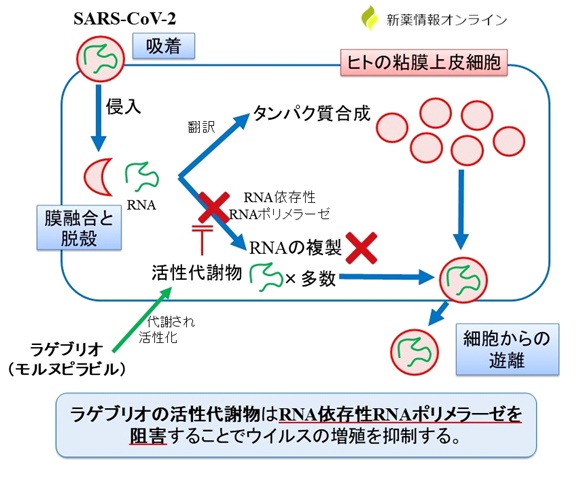
文献1)より転載
臨床効果はランダム化プラセボ対照二重盲検試験という最も信頼性の高い方法で行われており、対象は軽度~中等症の入院を必要としないCOVID-19患者で、偽薬(プラセボ)またはモルヌピラビル(おそらく1日2回 5日間)服用したグループを比較しています。
| プラセボ | モルヌピラビル | |
| 29日までの入院または死亡 | 14.1 % ( 53 / 377 ) 死亡8人 | 7.3 % ( 28 / 385 ) 死亡0人 |
29日までの入院または死亡に至った被験者の割合が、モルヌピラビル群で7.3%、プラセボ群で14.1%となり、リスク減少率は48%で統計学的に有意な差が認められました。ただし、全ての被験者を対象とした最終解析では、モルヌピラビル群で6.8%(48/709例)、プラセボ群で9.7%(68/699例)となり、リスク減少率は30%に低下しています2)。
またモルヌピラビルは変異株(ガンマ、デルタ、ミュー)に対しても一貫した有効性を示した、とも記載されています。 有害事象の発生率はモルヌピラビル群35% vsプラセボ群40%、薬物関連の有害事象の発生率はモルヌピラビル群12% vsプラセボ群11%、有害事象のために治療中断した患者の割合はモルヌピラビル群1.3% vsプラセボ群3.4%とほとんど副作用は認められていません。懸念材料は構造式が似ているアビガンで催奇形性が確認されていることです2)。
副作用はほとんどありませんが有効性についてはやや懸念材料がありそうです。ちなみに有効性の懸念から韓国やフランスでは使用を承認していないそうです。
モルヌピラビルの用法・用量は、18歳以上のCOVID-19患者に1回800mgを1日2回、5日間投与です。症状発現から6日目以降に投与を開始した患者における有効性を裏付けるデータはありません。また、SARS-CoV-2ワクチンの被接種者は臨床試験で除外されたため、ブレイクスルー感染での重症化予防などの有効性を裏付けるデータもありません。
投与対象は18歳以上の患者のうち、日本感染症学会の「COVID-19 に対する薬物治療の考え方 第 11 報」に従い、以下の危険因子を持っている人に投与が検討されます3)。以下に示します。
①61歳以上、②活動性のがん(免疫抑制または高い死亡率を伴わないがんは除く)、③慢性腎臓病(CKD)、④慢性閉塞性肺疾患(COPD)、⑤肥満(BMI 30kg/m2以上)、⑥重篤な心疾患(心不全、冠動脈疾患または心筋症)、⑦糖尿病、⑧ダウン症、⑨脳神経疾患(多発性硬化症、ハンチントン病、重症筋無力症など)、⑩コントロール不良のHIV感染症およびAIDS、⑪肝硬変などの重度の肝臓疾患、⑫臓器移植、骨髄移植、幹細胞移植後、などが当初発表されました。
しかし、後に英国での PANORAMIC 試験の組み入れ基準における重症化リスク因子、すなわち、慢性腎臓病、慢性肝疾患、慢性神経疾患、慢性精神疾患、ケアホーム居住者、臨床医または看護師が臨床的に脆弱と判断した場合3)、なども含まれるに至っては18歳以上の大半の人が投与対象に含まれることになりました。
妊婦には禁忌、妊娠可能な女性は投与中に服用後4日間の避妊がすすめられています4)5)。
授乳婦に対しては、「治療上の有益性および母乳栄養の有益性を考慮し、授乳の継続または中止を検討すること」となっていますが、臨床試験では授乳を避けることが指示されていました。
SARS-CoV-2陽性例が周囲との接触を極力避けるため、患者が薬局に行かずに自宅や宿泊療養施設に配送できる仕組みが整備されています。つまり、病院や医院で薬局に処方箋をFAXし、薬局は患者さんに服薬指導をしたのちに薬剤を患者さん宅に配送するようになっています。一部の病院や薬局で在庫配置も可能になるそうです。
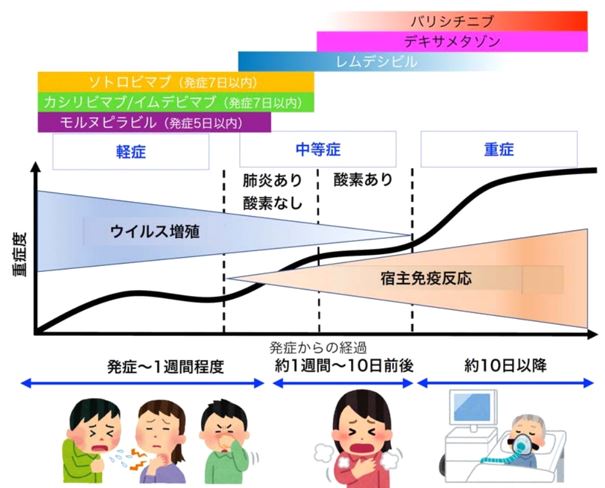
文献1)より転載
モルヌピラビル(商品名ラゲブリオ)は重症化リスクをもった18歳以上の新型コロナ感染症の軽症~中等症の発症5日間までの外来治療として期待されるところです。
ただ、今後承認されるであろうファイザー社の内服薬よりやや効果が劣るデータです。
| モルヌピラビル (ラゲブリオ) | ニルマトレルビル・リトナビル (パクスロビド) | |
| 開発 | メルク(国内の販売元はMSD) | ファイザー |
| 承認 | 2021年12月24日 特例承認 | 米国では承認 日本では未承認 |
| 作用機序 | RNA依存性RNAポリメラーゼ阻害 | 3CLプロテアーゼ阻害 |
| 使用時期 | 発症5日以内 | 発症5日以内 |
| 用法容量 | 1回4カプセル1日2回 5日間 | 1回3錠1日2回 5日間 |
| 対象 | 18歳以上、重症化リスク因子を有する軽症~中等症 | 12歳以上、40㎏以上、重症化リスク因子を有する軽症~中等症 |
| 効果 | 入院あるいは死亡のリスクを プラセボより30%減少 | 入院あるいは死亡のリスクを プラセボより89%減少 |
なお、ラゲブリオは特例承認であるため患者同意書が必要です6)。薬剤費の患者負担はありません。COVID-19 の診断はPCR、抗原定性・定量いずれでも適応されます。令和4年1月4日現在、当院での処方はまだできませんが数日中に処方できるように準備中です。
令和4年1月4日
菊池中央病院 中川義久
参考文献
1)ラゲブリオ(モルヌピラビル)の作用機序・特徴【COVID-19】
https://passmed.co.jp/di/archives/16908
2)厚労省がMerck社のモルヌピラビルを特例承認、初のCOVID-19経口薬
https://medical.nikkeibp.co.jp/leaf/mem/pub/report/t344/202112/573334.html?n_cid=nbpnmo_mled
3)新型コロナウイルス感染症における経口抗ウイルス薬の医療機関及び薬局への配分について
https://www.mhlw.go.jp/content/000873667.pdf
4)コロナ初の経口薬、使用上の注意点・入手法は
https://medical-tribune.co.jp/news/2021/1227542754/?utm_source=recent&utm_medium=email&utm_campaign=mailmag211228
5)ラゲブリオ添付文書
https://www.msdconnect.jp/static/mcijapan/images/pi_lagevrio_inf.pdf
6)患者同意書
https://view.officeapps.live.com/op/view.aspx?src=https%3A%2F%2Fwww.msdconnect.jp%2Fstatic%2Fmcijapan%2Fimages%2Fdoui_lagevrio.docx&wdOrigin=BROWSELINK




